গ্লুকোজ-উদ্দীপিত ইনসুলিন নিঃসরণ: মাইটোকন্ড্রিয়ার ভূমিকা
- প্রকাশ: ০৭:১৩:২৪ অপরাহ্ন, সোমবার, ৩ এপ্রিল ২০২৩
- / ৭১৭ বার পড়া হয়েছে
ডায়াবেটিস হলো একটি বিশ্বব্যাপী স্বাস্থ্য সমস্যা। প্রাথমিক পর্যায়ে বিটা (β)-কোষের পর্যাপ্ত মাত্রায় ইনসুলিন নিঃসরণে অক্ষমতার কারণেই এই রোগটি দেখা দেয়। বলা বাহুল্যঃ অগ্ন্যাশয়ের বিটা-কোষগুলোই হচ্ছে ইনসুলিনের একমাত্র উৎস। বিটা-কোষ হলো অগ্ন্যাশয়-আইলেটের বিশিষ্ট ধরণের একগুচ্ছ কোষ যার থেকে সংশ্লেষিত ও নিঃসৃত হয় ইনসুলিন, ৫১টি অ্যামিনো অ্যাসিড-বিশিষ্ট একটি প্রোটিনধর্মী হরমোন। এছাড়াও, আইলেটে রয়েছে আলফা- (নিঃসৃত হয় গ্লুকাগন), ডেল্টা- (সোমাটোস্ট্যাটিন), গামা-(প্যানক্রিয়াটিক পলিপেপ্টাইড) এবং ইপ্সিলন (ঘ্রেলিন) ধরণের কোষ যারা প্রত্যেকেই বিভিন্ন ধরণের হরমোন নিঃসরণের সাথে জড়িত। টাইপ-২ ডায়াবেটিসে গ্লুকোজের প্রতি সাড়া দিতে β-কোষের ক্রমান্বয় ব্যর্থতার অন্তর্নিহিত আণবিক প্রক্রিয়াগুলো এখনও অনেকটাই অমীমাংসিত রয়ে গেছে। তবে, বিজ্ঞানীরা একমত হয়েছেন যে, বিটা-কোষের মাইটোকন্ড্রিয়া ইন্সুলিন নিঃসরণে একটি মূল ভূমিকা পালন করে। দেখা গিয়েছে, ডায়াবেটিসে আক্রান্ত রোগীদের যাদের মাইটোকন্ড্রীয় ডিএনএ (mtDNA) বা মাইটোকন্ড্রিয়া-সম্পর্কিত নিউক্লীয় ডিএনএ-তে মিউটেশন রয়েছে, তাদেরই মূলত অগ্ন্যাশয়ের বিটা-কোষের ইনসুলিন নিঃসরণে দেখায় প্রতিবন্ধকতা। কারণ, মাইটোকন্ড্রিয়া থেকে উৎপন্ন ATP/এটিপি হচ্ছে গ্লুকোজ-উদ্দীপিত ইনসুলিন নিঃসরণের একটি প্রধান নিয়ন্ত্রক। গ্লুকোজ ছাড়াও কিছু অ্যামিনো অ্যাসিড যেমন লিউসিন ও গ্লুটামিন ইনসুলিন নিঃসরণের উদ্দীপক হিসেবে কাজ করে। তবে, ইনসুলিন ক্ষরণের জন্য গ্লুকোজ হলো প্রধান ও সবচেয়ে শক্তিশালী উত্তেজক। তাই ইন্সুলিন নিঃসরণের উদ্দীপক হিসেবে গ্লুকোজ ছাড়া অন্যান্য উদ্দীপক নিয়ে ব্যাখ্যা করা হয়নি এই প্রবন্ধে।
কর্মশক্তিপুর্ন ও সক্রিয় মাইটোকন্ড্রিয়া টাইপ-২ ডায়াবেটিস মেলিটাস (T2DM) ও তার রক্তসংবহন-সম্পর্কিত (ভাস্কুলার) জটিলতার ক্ষেত্রে অত্যন্ত গুরুত্বপূর্ণ। প্রকৃতপক্ষে, মাইটোকন্ড্রিয়া হলো ইনসুলিন নিঃসরণের প্রধান নিয়ন্ত্রক। তাই, মাইটোকন্ড্রিয়া ডিএনএ-র মিউটেশনগুলো টাইপ ২ ডায়াবেটিস বিকাশের সাথে সম্পর্কিত। শুধুমাত্র মাইটোকন্ড্রীয় ATP সিন্থেজ (ATP6/8) জিনের একটি C>G মিউটেশন (m.8561)ই যথেষ্ট, যা ডায়াবেটিস ও হাইপারগোনাডোট্রপিক হাইপোগোনাডিজম-এর কারণ বলে জানা গিয়েছে। এই মিউটেশনটির ফলে একটি অকার্যকর এটিপি সিন্থেজ তৈরি হয় যেখানে এটিপি উৎপাদনও হ্রাস পায়। প্রসঙ্গতঃ অ্যাডিনোসিন ডাইফসফেট (ADP) এবং অজৈব ফসফেট (Pi) ব্যবহার করে অক্সিডেটিভ ফসফোরিলেশন প্রক্রিয়ায় এটিপি সিন্থেজ এনজাইমটি ATP সংশ্লেষ করে।
ইনসুলিন
অগ্ন্যাশয়ের আইলেটস অব ল্যাঙ্গারহ্যান্সের বিটা কোষ (Islets of Langerhans, β-cells) থেকে নিঃসৃত এটি একটি প্রোটিনধর্মী হরমোন। চৌদ্দ হাজার নিউক্লিওটাইড (nucleotide) নিয়ে গঠিত ইনসুলিনের একটি মাত্র জিন (INS) মানবজিনোমের ১১ নং (11p15.5) ক্রোমোজোমে অবস্থিত। তবে, ইঁদুর গ্রুপ ও কতিপয় মাছ প্রজাতির মধ্যে একটি নয়, দুটি কার্যকরী ইনসুলিন জিন থাকে (INS-1 ও INS-2)। রক্তে গ্লুকোজের আধিক্যে ইনসুলিন জিনের প্রতিলিপিকরণ/ট্রান্সক্রিপশন বৃদ্ধি পায়। মানব বিটা-কোষে INS জিনের প্রতিলিপিকরণ কয়েকটি ট্রান্সক্রিপশন ফ্যাক্টর (PDX1, HNF1α, NeuroD1 এবং MafA) দ্বারা নিয়ন্ত্রিত। এই চারটি ফ্যাক্টরের সম্মিলিত কর্মোদ্যোগের একটি জটিল প্রক্রিয়ায় INS এমআরএনএ (mRNA) তৈরির কাজটি সম্পন্ন করে। ১১০ অ্যামিনো অ্যাসিড-দীর্ঘ একটি পূর্বসূরি ইনসুলিন (preproinsulin) তিনটি ধাপে (প্রিপ্রোইনসুলিন-প্রোইনসুলিন-ইনসুলিন), বিভিন্ন এনজাইমের সহযোগিতায়, পরিবর্তিত হয়ে একটি সক্রিয় ইনসুলিন (৫১ অ্যামিনো অ্যাসিড বিশিষ্ট)’র পলিপেপ্টাইড A ও পলিপেপ্টাইড B-তে রূপ পায়। সংশ্লেষণসহ ওই বিশোধনগুলো ঘটে থাকে তিনটি অঙ্গাণুতে- রাইবোজোম, এন্ডোপ্লাজমিক রেটিক্যুলাম এবং গলজি বস্তুতে।
ইনসুলিন নিঃসরণে মাইটোকন্ড্রিয়ার ভূমিকা নিয়ে পর্যালোচনার পূর্বে মাইটোকন্ড্রিয়া সমন্ধে আমাদের একটি ভালো ধারণা থাকা প্রয়োজন।
মাইটোকন্ড্রিয়ার গঠন ও তার ডিএনএ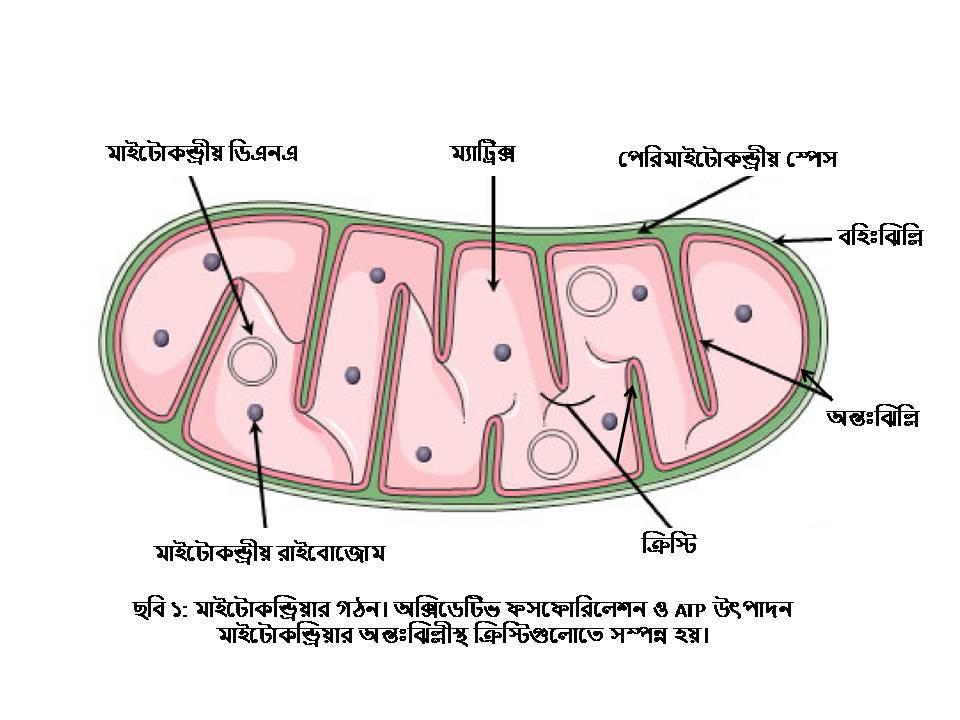
মাইটোকন্ড্রিয়া দ্বি-স্তরবিশিষ্ট আবরণী ঝিল্লি দ্বারা আবরিত সাইটোপ্লাজমস্থ একটি অঙ্গাণু, যা বেশিরভাগ প্রাণী, উদ্ভিদ এবং ছত্রাকের মধ্যে পাওয়া যায়। সাধারণত কোষ প্রতি শতাধিক মাইটোকন্ড্রিয়া অবস্থান করে। প্রতিদিন আনুমানিক ১০০ থেকে ১৫০ mol/L এটিপি প্রয়োজন, যার মানে হলো প্রতিটি এটিপি অণু প্রতিদিন প্রায় ১০০০ থেকে ১৫০০ বার পুনর্ব্যবহৃত হয়। অর্থাৎ, একজন স্বাভাবিক বিশ্রামরত প্রাপ্তবয়স্কদের মধ্যে প্রতিদিন প্রায় ৫০ থেকে ৬০ কেজি এটিপি পুনর্ব্যবহৃত হয়। কোষীয় শক্তি সরবরাহের পাশাপাশি, মাইটোকন্ড্রিয়া অন্যান্য কাজের সাথেও জড়িত, যেমন সংকেতসংবহন, কোষ, বিভাজন, কোষমৃত্যু এবং সেসাথে অগ্ন্যাশয়ের বিটা-কোষে ইন্সুলিনের নিঃসরণকেও নিয়ন্ত্রণ করে। মাইটোকন্ড্রিয়া প্রোটিন ও ফসফোলিপিড নির্মিত দুটি ইউনিট আবরণী বা ঝিল্লি দিয়ে গঠিত, যার মাঝে রয়েছে পেরিমাইটোকন্ড্রীয় স্পেস (৬০-৯০Å) যেখানে সাইটোক্রোম সি প্রোটিনের রয়েছে আধিক্য এবং সঞ্চিত থাকে প্রোটন (H+) যা সৃষ্টি করে একটি ইলেক্ট্রোকেমিক্যাল গ্র্যাডিয়েন্ট। দুটি ঝিল্লির মধ্যে বাইরের দিকের ঝিল্লিটিকে বহিঃঝিল্লি ও ভেতরের দিকের ঝিল্লিটিকে অন্তঃঝিল্লি বলে (দেখুন ছবি ১) এবং এই ঝিল্লিগুলোর পুরুত্ব ৬০Å। মাইটোকন্ড্রিয়ার ঝিল্লিদ্বয়ের দূরত্ব সাধারণত ৬০ – ৮০Å পর্যন্ত হতে পারে। প্রসঙ্গতঃ এক আংস্ট্রম হলো দৈর্ঘের একক যা এক ন্যানোমিটারের দশভাগের এক ভাগ। বহিঃঝিল্লিতে অবস্থান করে বিভিন্ন ধরণের ভোল্টেজ-নির্ভর অ্যান-আয়ন চ্যানেল (VDAC), যা নিউক্লিওটাইড, বিভিন্ন আয়ন ও মেটাবোলাইটগুলোকে সাইটোপ্লাজম থেকে পেরিমাইটোকন্ড্রীয় স্পেসে পারাপার করে। এছাড়া, বহিঃঝিল্লিতে রয়েছে গুরুত্বপূর্ণ কয়েকটি এনজাইম, যেমন মনোঅ্যামিন অক্সিডেজ, রোটেনোন-অসংবেদনশীল NADH-সাইটোক্রোম সি-রিডাক্টেজ, কাইনুরেনাইন হাইড্রোক্সিলেজ এবং ফ্যাটি অ্যাসিড কো-এ লাইগেজ। মাইটোকন্ড্রিয়ার ভেতরের ঝিল্লিটি কেন্দ্রীয় ম্যাটিক্সে অনিয়মিতভাবে ভাঁজ হয়ে যেসব বিভেদক প্রাচীর বা প্রবর্ধক সৃষ্টি করে তাদেরকে ক্রিস্টি (cristae) বলে। মাইটোকন্ড্রিয়ার এসব প্রবর্ধকগুলোতেই অক্সিডেটিভ ফসফোরিলেশন (OXPHOS), এটিপি সিন্থেজ ও অক্সিজোমের মাধ্যমে উৎপন্ন হয় এটিপি (দেখুন অক্সিডেটিভ ফসফোরিলেশন)। মাইটোকন্ড্রীয় অন্তঃঝিল্লির ভিতরে অর্ধতরল মাতৃকা বা ম্যাট্রিক্স রয়েছে, যেখানে বিদ্যমান বেশ কিছু এনজাইম ও কো-এনজাইম, মাইটোকন্ড্রীয় রাইবোজোম, tRNA, প্রোটিন, কোলেস্টেরল, লিপিড এবং বেশ কিছু বৃত্তাকার ছোট্ট ডিএনএ, যা “হিস্টোন” প্রোটিন দ্বারা সুরক্ষিত নয়। ম্যাট্রিক্সেই সংঘটিত হয় পাইরুভেট, ফ্যাটি অ্যাসিড এবং TCA চক্রের জারণ।
মানব-মাইটোকন্ড্রীয় জিনোম প্রায় ১৬,৫৬৯ নিউক্লিওটাইড সমন্বয়ে গঠিত একটি বৃত্তাকার ডিএনএ অণু, যা কোষের মোট ডিএনএ-র একটি ভগ্নাংশ মাত্র (১%)। মাইটোকন্ড্রীয় ডিএনএ হচ্ছে দ্বি-সূত্রক, রয়েছে একটি ভারী (Heavy) ও একটি হালকা (Light) স্ট্র্যান্ডI প্রসঙ্গতঃ একটি কোষে শতাধিক, এমনকি ২০০০ (যকৃত কোষ) পর্যন্ত মাইটোকন্ড্রিয়া সাইটোপ্লাজমে ভাসমান থাকে, এবং একেকটি মাইটোকন্ড্রিয়ায় বেশ কিছু বৃত্তাকার ডিএনএ অণু বিদ্যমান। মাইটোকন্ড্রীয় ডিএনএ-তে ৩৭টি জিন রয়েছে, যার সবকটিই স্বাভাবিক মাইটোকন্ড্রিয়ার কার্যক্রমের জন্য অপরিহার্য। জিনগুলোর মধ্য থেকে ভারী স্ট্র্যান্ড থেকে তৈরি হয় দুটি রাইবোজোমীয় RNA (12S rRNA এবং 16S rRNA), ১৪টি tRNA এবং ১২টি পলিপেপটাইড, যার সবকটি অক্সিডেটিভ ফসফোরিলেশন প্রক্রিয়ায় জড়িত: ৬টি প্রোটিন কমপ্লেক্স I সাবইউনিট (NADH Dehydrogenase/ND1, ND2, ND3, ND4, ND4, ND4L, ND5), কমপ্লেক্স III সাবইউনিট (সাইটোক্রোম b), তিনটি প্রোটিন কমপ্লেক্স IV সাবইউনিট (Cytochrome Oxidase/COI, COII, COIII), এবং দুটি কমপ্লেক্স V সাবুনিট (ATPase 6 এবং ATPase 8)। কমপ্লেক্স II, চারটি সাবুনিট-সহ, নিউক্লীয় ডিএনএ থেকে সংকেতপ্রাপ্ত। এছাড়া, ডিএনএ-র হালকা স্ট্র্যান্ড থেকে সংশ্লেষিত হয় ৮টি tRNA এবং একটি পলিপেপ্টাইড (ND6, কমপ্লেক্স I এর সাবইউনিট)। মাইটোকন্ড্রীয় ডিএনএ-র জিনগুলোতে কোনো ইন্ট্রোন (Intron) নেই এবং ১১১৮ bp নিয়ন্ত্রক-অঞ্চল ব্যতীত আন্তঃজেনিক (intergenic) সিকোয়েন্সও অনুপস্থিত। নিউক্লীয় ডিএনএর মতো mtDNA “হিস্টোন” প্রোটিন দ্বারা সুরক্ষিত নয়, তাই এটি অভ্যন্তরীণ বা বহিরাগত মিউটেজেনিক ফ্যাক্টরগুলোর প্রতি বেশি সংবেদনশীল। ক্ষতিগ্রস্থ mtDNA-কে মেরামত করা হয় যেসব এনজাইম দ্বারা সেগুলোর সবই আসে নিউক্লীয় ডিএনএ-র নির্দেশে। mtDNA-এর মিউটেশন যেসব রোগের সাথে সম্পৃক্ত: লী সিন্ড্রোম (Leigh syndrome: শিশুদের মস্তিষ্কের রোগ), MELAS (ল্যাকটিক অ্যাসিডোসিস), অপটিক নিউরোপ্যাথি (LHON), কার্ডিওমায়োপ্যাথি, পারকিনসন’স রোগ এবং টাইপ-২ ডায়াবেটিস। বলা বাহুল্যঃ জননকোষে, মাইটোকন্ড্রীয় ডিএনএ শুধুমাত্র ডিম্বাণুতে বিদ্যমান; ফলে, যদিও মা তার সব সন্তানের কাছে তার mtDNA পার করেন, কিন্তু শুধুমাত্র কন্যারাই তা পরবর্তী প্রজন্মের সকল সদস্যের কাছে প্রেরণ করার সক্ষমতা রাখেন। কদাচিৎ, বিভিন্ন প্রাণীতে, এমনকি মানুষের মধ্যেও, শুক্রাণু-বাহিত mtDNA মাঝে মধ্যে দেখা যায়।
অক্সিডেটিভ ফসফোরিলেশন (OXFOS)
কোষীয় শ্বসন প্রক্রিয়া তিনটি অংশ নিয়ে গঠিত: গ্লাইকোলাইসিস (glycolysis), TCA চক্র এবং অক্সিডেটিভ ফসফোরিলেশন। OXPHOS-এর দুটি অংশ রয়েছে: ইলেক্ট্রন ট্রান্সপোর্ট চেইন (electron transfer chain, ETC) এবং কেমিওসমোসিস (chemiosmosis)। ETC-র জারণ বা রেডক্স বিক্রিয়ায় (জারণ হলো হাইড্রোজেন এর অপসারণ) ৪টি এনজাইম কমপ্লেক্স জড়িত: ১) প্রোটিন কমপ্লেক্স I (Ubiquinone oxidoreductase); ২) প্রোটিন কমপ্লেক্স II (Succinate–dehydrogenase); ৩) প্রোটিন কমপ্লেক্স III (Cytochrome-c reductase) এবং ৪) প্রোটিন কমপ্লেক্স IV (cytochrome-c oxidase)। TCA চক্র এবং বিটা-অক্সিডেশনের মাধ্যমে সৃষ্ট দুটি ইলেক্ট্রন দাতা বা বিজারক, NADH (Nicotinamide Adenine Dinucleotide+hydrogen) এবং FADH2 (Flavin Adenine Dinucleotide+ hydrogen), থেকে ইলেকট্রন যথাক্রমে কমপ্লেক্স I এবং কমপ্লেক্স II এর মধ্য দিয়ে ইলেকট্রন পরিবহন শৃঙ্খল (ETC)এ প্রবেশ করে। এই দুটি কমপ্লেক্স থেকে, ইলেকট্রনগুলো কোএনজাইম Q (CoQ) এর মাধ্যমে পর্যায়ক্রমে কমপ্লেক্স III-এ এবং পরবর্তীতে সাইটোক্রোম সি (cytochrome C)-এর মাধ্যমে কমপ্লেক্স IV সাবইউনিটে স্থানান্তরিত হয় (দেখুন ছবি ২)। সাইটোক্রোম সি জারিত হয়ে ইলেক্ট্রন স্থানান্তরিত হয়ে যায় জারক অক্সিজেনের কাছে। ইলেকট্রন পরিবহনের সময়, মুক্ত শক্তি নির্গত হয় প্রোটন (H+)এর মাধ্যমে যা সঞ্চিত হতে থাকে পেরিমাইটোকন্ড্রিয়াল স্পেসে। ফলশ্রুতিতে, মাইটোকন্ড্রিয়ার অন্তঃঝিল্লি জুড়ে প্রোটন গ্র্যাডিয়েন্ট রূপান্তরিত হয় ইলেক্ট্রোকেমিক্যাল গ্র্যাডিয়েন্টে, যা এটিপি উৎপাদনের চালিকা শক্তি হিসাবে কাজ করে এবং প্রোটিন কমপ্লেক্স V বা এটিপি সিন্থেজ (ATP synthase) নামক একটি এনজাইমকে উজ্জীবিত করে, উৎপাদিত হয় এটিপি। ৪টি H+/প্রোটনের পক্ষে এটিপি সিন্থেজ একটি এটিপি (ATP) অণু সংশ্লেষ করে। গ্লাইকোলাইসিস ও TCA চক্রের তুলনায়, যেখানে উৎপন্ন হয় মাত্র ২টি করে এটিপি, ETC-অক্সিডেটিভ ফসফোরিলেশনের মাধ্যমে এক অণু গ্লুকোজ থেকে তৈরি হয় ৩৪টি এটিপি। অর্থাৎ একটি গ্লুকোজ অণু থেকে উপরোক্ত চারটি প্রক্রিয়ায় তৈরি হয় সর্বমোট ৩৮টি এটিপি। যদিও অক্সিডেটিভ ফসফোরিলেশন বিপাকের একটি গুরুত্বপূর্ণ অংশ, এটি অতি প্রতিক্রিয়াশীল অক্সিজেন যথা সুপারঅক্সাইড (O2−), হাইড্রোজেন পারোক্সাইড (H2O2), এবং হাইড্রক্সিল গ্রুপ (OH–)-এর মতো মুক্ত র্যাডিক্যাল (free radical) তৈরি করে, যা কোষের প্রোটিন, লিপিড ও mtDNA এর জন্য খুব ক্ষতিকর এবং তারা ডায়াবেটিস-সহ বিভিন্ন রোগ সৃষ্টিতেও অবদান রাখে। প্রসঙ্গতঃ FADH-এর উপস্থিতিতে প্রোটিন কমপ্লেক্স I এর পরিবর্তে প্রোটিন কমপ্লেক্স II অগ্রণী ভূমিকা নেয়, সেখান থেকেই ইলেক্ট্রন ট্রান্সফার শুরু হয়।
পটাসিয়াম চ্যানেল (Potassium channel)
এটিপি-নিয়ন্ত্রিত বিটা-কোষঝিল্লীতে আবদ্ধ পটাসিয়াম চ্যানেলগুলো ইনসুলিন নিঃসরণে অত্যান্ত গুরুত্বপূর্ণ। এটি হচ্ছে আয়ন চ্যানেল। এই চ্যানেলগুলো গুরুত্বপূর্ণ ঝিল্লি পরিবহন (transporter) প্রোটিনগুলোর মধ্যে একটি। কাঠামোগতভাবে চারটি প্রোটিন সাবইউনিট একত্রিত হয়ে একটি ফুটো তৈরি করে, যার ভিতর দিয়েই পটাসিয়াম আয়ন পারাপার করে। স্তন্যপায়ী প্রাণিদের এরকম ৮০ টিরও বেশি জিন রয়েছে যা পটাসিয়াম চ্যানেল সাবুনিটগুলোকে এনকোড করে। সাধারণত চার ধরণের পটাসিয়াম চ্যানেল দেখা যায়: ১) ক্যালসিয়াম-সক্রিয় পটাসিয়াম চ্যানেল (যা ক্যালসিয়ামের উপস্থিতিতে পটাসিয়াম চ্যানেলটি সক্রিয় হয়); ২) অন্তর্মুখী সংশোধনকারী পটাসিয়াম চ্যানেল; ৩) ট্যান্ডেম পোর ডোমেইন পটাসিয়াম চ্যানেল; এবং ৪) ভোল্টেজ-গেটেড পটাসিয়াম চ্যানেল (এগুলো সক্রিয় হতে বৈদ্যুতিক বা জৈবিক সংকেত প্রয়োজন)। এই চ্যানেলগুলোর মাধ্যমে সাধারণত পটাসিয়াম আয়ন (K+) কোষের ঝিল্লি জুড়ে তাদের ঘনত্ব গ্রেডিয়েন্টের উপর নির্ভর করে পরিবাহিত হয়। যেদিকে পটাসিয়াম আয়নের ঘনত্ব বেশী, সেদিক থেকে K+ নিম্ন ঘনত্বের তরলে যাবার প্রবনতা দেখা দেয়। বিটা-কোষে অবস্থিত পটাসিয়াম চ্যানেল (KATP)গুলো কোষাভ্যন্তরে ATP-ঘনত্বের উপর ভিত্তি করে বিটা-কোষ থেকে ইনসুলিন নিঃসরণকে নিয়ন্ত্রণ করে, ফলে তাদের ত্রুটি ডায়াবেটিস রোগের কারণ হতে পারে। একটি KATP চ্যানেল দুটি সাবইউনিটের সমন্বয়ে গঠিত- সালফোনিলুরিয়া রিসেপ্টর 1 (SUR1, যা মানব ABCC8 জিন দ্বারা সংকেতপ্রাপ্ত) এবং অন্তর্মুখী সংশোধনকারী K+ চ্যানেল। সালফোনিলুরিয়া (যেমন গ্লিপিজাইড, গ্লিমিপিরাইড) জাতীয় ডায়াবেটিস-প্রতিরোধক ওষুধগুলো SUR1 রিসেপ্টরকে প্রতিরোধ ক’রে ঠিক এই পদ্ধতিতেই কাজ করে এবং বিটা-কোষ থেকে ইনসুলিনের ক্ষরণকে বৃদ্ধি করে।
ইনসুলিন নিঃসরণে মাইটোকন্ড্রিয়ার TCA চক্রের ভূমিকা
TCA চক্র হলো বিপাকের একটি কেন্দ্র। শক্তি উৎপাদন এবং জৈব সংশ্লেষণ উভয় ক্ষেত্রেই এই চক্রটির কেন্দ্রীয় গুরুত্ব রয়েছে। অগ্ন্যাশয়ের বিটা-কোষগুলো হলো বিশেষ ধরণের এক অন্তঃস্রাবী কোষ যা ক্রমাগত রক্তে শর্করার মাত্রা অনুভব করে এবং প্রতিক্রিয়া হিসেবে রক্তে স্বাভাবিক গ্লুকোজ-হোমিওস্ট্যাসিস বজায় রাখতে ইনসুলিন নিঃসরণ করে। খাওয়ার পরে, রক্তে গ্লুকোজের মাত্রা দ্রুত বৃদ্ধি পায়, যা অনুভূত হয় গ্লুকোকাইনেজ (glucokinase) এনজাইম দ্বারা। ফলশ্রুতিতে, ইনসুলিন নিঃসরণ উদ্দীপিত হয়, সাথে যকৃত থেকে গ্লুকোজ আউটপুট হ্রাস পায় এবং অন্যান্য টিস্যুতে, প্রধানত পেশী ও অ্যাডিপোজ টিস্যুতে গ্লুকোজ বিপাককে উৎসাহিত করে। বিটা-কোষাভ্যন্তরে গ্লুকোজ প্রবেশ করে ঝিল্লীবদ্ধ গ্লুকোজ ট্রান্সপোর্টার প্রোটিন দ্বারা – ইঁদুর-জাতীয় প্রাণীর ক্ষেত্রে সেই বাহকটি হলো GLUT২ এবং মানুষের ক্ষেত্রে GLUT১, কিন্তু মানব অ্যাডিপোজ ও পেশি কোষে সে পরিবাহী প্রোটিনটি হলো GLUT4।
ATP-নির্ভর ইনসুলিন নিঃসরণ
ক্রেব’স চক্রের প্রথম উৎপন্ন পদার্থ হলো সাইট্রিক অ্যাসিড (সাইট্রেট), তাই এ চক্রকে সাইট্রিক অ্যাসিড চক্র (citric acid cycle) বলা হয় এবং সাইট্রিক অ্যাসিডে ৩টি কার্বক্সিল (-COOH) গ্রুপ থাকায় একে ট্রাই-কার্বক্সিলিক অ্যাসিড (TCA) চক্র-ও বলা হয়। এই রচনায় ক্রেব’স এর পরিবর্তে চক্রটিকে TCA হিসেবেই উল্লেখ করা হয়েছে। কোষের সাইটোপ্লাজমে গ্লাইকোলাইসিস প্রক্রিয়ায় গ্লুকোজ থেকে পাইরুভেট এ রূপান্তর এবং মাইটোকন্ড্রিয়ায় (মাইটোকন্ড্রিয়ার ম্যাট্রিক্সে) পাইরুভেট/অ্যাসিটিল-CoA TCA চক্রের মাধ্যমে NADH ও FADH উৎপাদন এবং অবশেষে সেগুলো মাইটোকন্ড্রিয়ার অন্তঃআবরণী জুড়ে ইলেক্ট্রন পরিবহন ও অক্সিডেটিভ ফসফোরিলেশনের মাধ্যমে জারিত হয়ে ATP উৎপাদন করে। এখানে উল্লেখ্য যে, পাইরুভেট ডিহাইড্রোজিনেজ (pyruvate dehydrogenase, PDH) এবং পাইরুভেট কার্বক্সিলেজ (pyruvate carboxylase, PC) উভয়ই প্রভূত পরিমাণে মানব বিটা-কোষে পাওয়া যায়। প্রথমটি গ্লাইকোলাইসিস-উদ্ভুত পাইরুভেটকে জারণের মাধ্যমে রূপান্তর করে অ্যাসিটিল-CoA তে, যা গ্লাইকোলাইসিস প্রক্রিয়াকে TCA চক্রের সাথে যুক্ত করে। এবং শেষোক্ত এনজাইম দ্বারা পাইরুভেট থেকে তৈরি হয় অক্সালোঅ্যাসিটেট (OAA)- TCA চক্রের একটি মধ্যবর্তী পদার্থ। গ্লুকোজ-উদ্দীপিত ইনসুলিন ক্ষরণে PC-র ভূমিকা অত্যান্ত গুরুত্বপূর্ণ। তারই প্রমাণ মিলেছে গবেষণাগারে যেখানে আণবিকভাবে PC-কে দমন করা হলে ইনসুলিন ক্ষরণও কমে যায়। বিপরীতে, ইনসুলিনের ক্ষরণ বেড়ে যায় যদি PC জিনের প্রকাশকে বৃদ্ধি করা হয়। এছাড়াও, অক্স্যালোঅ্যাসিটেট Akt Ser473 ফসফোরিলেশন, mTOR Ser2448 ফসফোরিলেশন এবং P70S6K Thr389 ফসফোরিলেশন বৃদ্ধির মাধ্যমে ইনসুলিন সিগন্যালিং পথকে উজ্জীবিত করে।
প্রকৃতপক্ষে, অগ্নাশয়ের বিটা-কোষগুলোর মাইটোকন্ড্রিয়া ইনসুলিন নিঃসরণে একটি মুখ্য ভূমিকা পালন করে। অগ্নাশয়ের বিটা-কোষগুলো ইনসুলিন সংশ্লেষ করে এবং এর নিঃসরণ প্রধানত গ্লুকোজের মাত্রা দ্বারা পরিমিত হয়। রক্তে অতিরিক্ত গ্লুকোজ β-কোষে অক্সিডেটিভ ফসফোরিলেশনের হারকে উদ্দীপিত করে, সাথে এটিপি/এডিপি অনুপাতকে বৃদ্ধি করে। দুটি মূল জৈব রাসায়নিক পদ্ধতি গ্লাইকোলাইসিস এবং টিসিএ-চক্রের মাধ্যমে ATP/এটিপি উৎপাদনের জন্য গ্লুকোজবিপাক জড়িত, যা এটিপি-সংবেদনশীল পটাসিয়াম চ্যানেল (KATP)গুলোকে রদ করে, বিপরীতে ভোল্টেজ-গেটেড ক্যালসিয়াম চ্যানেলকে সক্রিয় করে। ফলে অন্তঃকোষীয় ক্যালসিয়াম (Ca2+) বৃদ্বি পায়1 ফলে, কোষটিতে ডিপোলারাইজেশন (depolarization) অবস্থার সৃষ্টি হয়, অর্থাৎ স্থিতিশীল অবস্থার চাইতে কোষটির মেমব্রেন পটেশিয়াল গিয়ে দাঁড়ায় ধনাত্মকে, যা রক্তে গ্লুকোজের মাত্রা স্বাভাবিক পর্যায়ে রাখার জন্য রক্ত প্রবাহে ইনসুলিনের নিঃসরণকে উৎসাহিত করে (দেখুন ছবি ৩)।
প্রসঙ্গতঃ স্থিতিশীল অবস্থায় অন্তস্থ তরলের রেস্টিং মেমব্রেন পটেশিয়াল থাকে সাধারণত -৭০ মিলিভোল্ট। একটি KATP চ্যানেল দুটি সাবইউনিটের সমন্বয়ে গঠিত- সালফোনিলুরিয়া রিসেপ্টর 1 (SUR1, যা মানব ABCC8 জিন দ্বারা সংকেতপ্রাপ্ত) এবং অন্তর্মুখী সংশোধনকারী K+ চ্যানেল। অধিকন্তু,সাইটোসোলিক NADPH সেন্ট্রিন/SUMO-নির্দিষ্ট প্রোটিয়েজ-১ (SENP1)কে উদ্দীপিত করে যা ইনসুলিন নিঃসরণের পথ (এক্সোসাইটোসিস)কেও সক্রিয় করে। অতএব, ইনসুলিন নিঃসরণ মাইটোকন্ড্রিয়ার বায়োএনার্জেটিক অবস্থার ওপর নির্ভরশীল। এছাড়া, ইনসুলিন-বাহিত সংকেতসংবহনও জৈবিকশক্তি দ্বারা প্রভাবিত। গ্লুকোজের অভাব বা ইলেক্ট্রন পরিবহন ও অক্সিডেটিভ ফসফোরিলেশনের ত্রুটি ইনসুলিন প্রতিরোধের কারণ হিসেবে দেখা গিয়েছে।
ইনসুলিনের সাথে এটিপি-ও নিঃসৃত হয় বিটা-কোষের বাইরে যা একটি সংকেত অণু হিসাবে β কোষের প্লাজমা ঝিল্লিতে অবস্থিত পিউরিন 2 (P2) রিসেপ্টরকে সক্রিয় করে। দেখা গিয়েছে, অন্তঃকোষীয় এবং বহিঃকোষী ATP উভয়ই FAM3A প্রোটিনের প্রভাবে কোষীয় Ca2+ মাত্রা, PDX1 এক্সপ্রেশন এবং ইনসুলিন নিঃসরণকে নিয়ন্ত্রণ করে।
ATP-অনির্ভর ইনসুলিন নিঃসরণ
এটা এখন অনেকটাই স্পষ্ট যে ATP-নির্ভরতা ছাড়াও পটাসিয়াম চ্যানেলগুলো ভিন্ন পন্থায় স্বাধীনভাবে গ্লুকোজ-উদ্দীপিত ইনসুলিন ক্ষরণকে বাড়াতে পারে। অর্থাৎ, গ্লুকোজের প্রতিক্রিয়ায় KATP-নির্ভর এবং KATP-স্বাধীন উভয় কার্যকলাপের মধ্য দিয়েই ইনসুলিনের সর্বাধিক নিঃসরণ নিশ্চিত কর হয়। ATP উৎপাদন ছাড়াও মাইটোকন্ড্রিয়া বিপাকীয় পদার্থ সংশ্লেষণ করে (অ্যানাপ্লেরোসিস/anaplerosis), যা ইন্সুলিন ক্ষরণে সহযোগিতা করে। অতএব, মাইটোকন্ড্রিয়াতে টিসিএ চক্র বিপাকের ঘনত্ব নিয়ন্ত্রণ করা কোষের জন্য অত্যন্ত গুরুত্বপূর্ণ। পাইরুভেট কার্বক্সিলেজ (pyruvate carboxylase, PC) একটি অ্যানাপ্লেরোটিক এনজাইম যা গ্লুকোনিওজেনেসিস, ফ্যাটি অ্যাসিড সংশ্লেষণ, অ্যামিনো অ্যাসিড সংশ্লেষণ এবং গ্লুকোজ-উদ্দীপিত ইনসুলিন নিঃসরণ-সহ বিভিন্ন কোষীয় বিপাকে একটি অপরিহার্য ভূমিকা পালন করে। বিটা-কোষগুলোতে অধিক পরিমানে PC এনজাইম রয়েছে যা পাইরুভেট-কে অক্স্যালোঅ্যাসিটেট (Oxaloacetate, OAA) এ রূপান্তর করে। টিসিএ চক্র, গ্লুকোনিওজেনেসিস এবং গ্লিসারোনিওজেনেসিস-সহ বেশ কয়েকটি বিপাকীয় পথের মধ্যবর্তী পদার্থ হচ্ছে OAA। টিসিএ চক্র থেকে OAA-রূপান্তরিত ম্যালেট (malate)বেরিয়ে আসে সাইটোপ্লাজমে যা প্রত্যাবর্তন করে পাইরুভেটে। এ দু’য়ের চলাচলে উৎপন্ন হয় NADPH, NADP+ এর বিজারিত রূপ যা প্রোটনের উৎস হিসেবে কাজ করে।
বিকল্প পথে OAA রূপান্তরিত হয় সাইট্রেট পদার্থে যা সাইট্রেট/আইসোসাইট্রেট ট্রান্সপোর্টার প্রোটিন (CTP)র মাধমে সাইটোপ্লাজমে বেরিয়ে আসে। এই পাথওয়েতে NADP-নির্ভর আইসোসাইট্রেট ডিহাইড্রোজেনেজ (IDH) উৎসেচকের মাধ্যমে সাইটোপ্লাজমীয় আইসোসাইট্রেটকে α-কিটোগ্লুটারেট/ketoglutarate (যা 2-oxoglutarate, 2OG নামেও পরিচিত) এ সরাসরি রূপান্তর করা হয়। আইসোসাইট্রেট ডিহাইড্রোজিনেজ-২(IDH2) এর মাধ্যমে TCA চক্র প্রবাহ গ্লুকোজ- এবং গ্লুটামিন-উদ্দীপিত ইনসুলিন নিঃসরণের জন্য গুরুত্বপূর্ণ। এই পথটি IDH1 দ্বারা সাইটোপ্লাজমীয় NADPH উত্পাদন চালনা করার জন্য সাইট্রেট এবং আইসোসিট্রেটের উত্স হিসাবে কাজ করে, যার ফলে ইনসুলিন নিঃসরণের পথটি (এক্সোসাইটোসিস) সক্রিয় হয়। গবেষণায় দেখে গিয়েছে, আণবিকভাবে CTP প্রকাশকে দমন করা হলে সাইটোপ্লাজমীয় সাইট্রেটের পরিমাণ কমে যায়, ফলে গ্লুকোজ-উদ্দীপিত ইনসুলিন ক্ষরণও কমে আসে। একইভাবে IDH এনজাইমের প্রকাশকেও দমন করা হলে ইনসুলিন ক্ষরণের হারও অনেকাংশে হ্রাস পায়।
β-কোষে গ্লুকোজের ঘনত্ব বৃদ্ধির পর মুহূর্তের মধ্যে গ্লুকোজ বিপাকের ফলস্বরুপ NADPH/NADP+ অনুপাতের বৃদ্ধি ইনসুলিন ক্ষরণকে উদ্দীপিত করে। এছাড়া, NAD কাইনেজ (NADK)দ্বারা অনুঘটন বা ফসফোরিলেশনের মাধ্যমে NAD+ রূপান্তরিত হয় NADP+ -এ এবং এইভাবে বিটা-কোষে নিয়ন্ত্রণ করে NADPH:NADP+ অনুপাত ও নিয়ন্ত্রণ করে ইনসুলিন নিঃসরণ। এটা প্রমাণ করে যে NADK হলো বিটা-কোষ জারণ এবং বিপাকীয় নেটওয়ার্কের একটি অবিচ্ছেদ্য অংশ। এমনকি, গবেষণায় দেখা গিয়েছে যে, NADK প্রকাশকে দমন করা হলে গ্লুকোজ-উদ্দীপিত ইনসুলিন নিঃসরণ উল্লেখযোগ্যভাবে বাধাপ্রাপ্ত হয়।
উপসংহার
গত দুই দশকের গবেষণায় পর্যাপ্ত প্রমাণ মিলেছে যে মাইটোকন্ড্রিয়ার কার্যাবলী ডায়াবেটিসের বিভিন্ন কারণসমূহের সাথে ঘনিষ্ঠভাবে সম্পর্কিত, যেমন অগ্ন্যাশয়ের বিটা-কোষের অকার্যকারিতা, ইনসুলিন প্রতিরোধ্যতা, স্থূলতা এবং ডায়াবেটিস-সংক্রান্ত রক্তসংবহন জটিলতা। মাইটোকন্ড্রিয়া হলো অত্যন্ত গতিশীল কোষীয় অঙ্গাণু, যা বিটা-অক্সিডেশন ও ATP উৎপাদনের মাধ্যমে বিটা-কোষে ইনসুলিন নিঃসরণে গুরুত্বপূর্ণ ভূমিকা পালন করে। তবে, মাইটোকন্ড্রিয়ার স্বল্প- ও দীর্ঘমেয়াদী বিপাকীয় সমস্যার কারণে ইনসুলিন ক্ষরণে বিঘ্নতা ঘটে। বিভিন্ন গবেষণায় দেখা গিয়েছে যে, অকার্যকর মাইটোকন্ড্রিয়া গড়ে তুলে ইনসুলিন প্রতিরোধ্যতা, যা T2DM-এর বৈশিষ্ট্য। অতিরিক্ত চর্বিগ্রহণও মাইটোকন্ড্রিয়াকে অকার্যকর করে তুলে। মাইটোকন্ড্রিয়ার অকার্যকারিতার জিনগত যেসব কারণ রয়েছে তম্মধ্যে মাইটোকন্ড্রীয়-ডিএনএ (mtDNA) এর মিউটেশন উল্লেখযোগ্য। লিউসিন tRNA জিনের মিউটেশন-সহ প্রায় mtDNA এর পঞ্চাশটিরও বেশি মিউটেশন চিহ্নিত হয়েছে যা সরাসরি T2DM এর সাথে সম্পৃক্ত।
এছাড়া, যেসব ট্রান্সক্রিপশন ফ্যাক্টর ইন্সুলিন জিনের প্রকাশ ও ইনসুলিন নিঃসরণের সাথে জড়িত সেগুলোর মিউটেশনও গ্লুকোজ-উদ্দীপিত ইনসুলিন নিঃসরণকে বাধাগ্রস্ত করে। যেমন, TFAM (মাইটোকন্ড্রীয় ট্রান্সক্রিপশন ফ্যাক্টর A) ও HNF-1a জিনের মিউটেশনের ফলে বাধাপ্রাপ্ত হয় মাইটোকন্ড্রীয় ATP উৎপাদন, পরিবর্তিত হয় মাইটোকন্ড্রীয় ঝিল্লির বিভব বা পোটেনশিয়াল, ফলে দেখা দেয় অন্তঃকোষীয় ক্যালসিয়ামের অপর্যাপ্ততা। এছাড়া, KATP চ্যানেলের SUR1 সাবইউনিট জিন (ABCC8)-র মিউটেশনের কারণেও ইনসুলিন ক্ষরণে অস্বাভাবিকতা দেখা যায়। এসব অস্বাভাবিকতা ইনসুলিন সংশ্লেষণ ও ক্ষরণে প্রতিবন্ধকতা সৃষ্টি করে, দেখা দেয় ইনসুলিন-প্রতিরোধ্যতা। খাদ্যের পুষ্টিগুণ, যেমন ওমেগা-৩ ফ্যাটি অ্যাসিড, কম-চর্বিযুক্ত খাবার, খাদ্যে বায়োঅ্যাকটিভ উপাদান- অর্থাৎ পলিফেনল (উৎস: বাদাম, জলপাই, চা-কফি, বেরি-জাতীয় ফল), ক্যারোটিনয়েড (রঙিন ফল ও সবজি), টারপেনয়েড (কমলা ও কমলা জাতীয় ফল), স্যাপোনিন (সয়াবিন, চানা, মটরশুটি, বরবটি ও অন্যান্য শিমজাতীয় বিজ) গ্লুকোসিনোলেট-সম্মৃদ্ধ শাকসব্জি (যেমন ব্রকলি, ফুলকপি, মূলা), অ্যান্টিঅক্সিডেন্ট, ভিটামিন এবং ক্যালরি সীমাবদ্ধতা ইনসুলিন-সংবেদনশীলতা বৃদ্ধি করে এবং প্রতিরোধ করে যাবতীয় মাইটোকন্ড্রিয়া-সংযুক্ত বিপাকীয় সমস্যা ।
____________________________
লেখকদ্বয়: প্রফেসর ড. রাশিদুল হক, সাবেক উপ-উপাচার্য, বরেন্দ্র বিশ্ববিদ্যালয়, রাজশাহী, এবং সাবেক অধ্যাপক, এমোরি বিশ্ববিদ্যালয়, আটলান্টা, যুক্তরাষ্ট্র, ও প্রাণিবিদ্যা বিভাগ, রাজশাহী বিশ্ববিদ্যালয়, বাংলাদেশ। ড. সুলতানা রাজিয়া, সহকারী অধ্যাপক, সেন্টার ফর ইন্টারডিসিপ্লিনারি রিসার্চ (CIR), বরেন্দ্র বিশ্ববিদ্যালয়, রাজশাহী, বাংলাদেশ।